2-D(Two-Dimensional Electrophoresis)双向电泳-质谱技术服务
2-D双向电泳是目前为止最有效、使用最多的蛋白分离方法,是一种分析从细胞、组织或其他生物样本中提取的蛋白质混合物的有力手段,已得到广泛应用。这项技术利用蛋白质的两种特性,分两步将不同的蛋白质分离。第一向步骤为等电聚焦(IEF),即根据蛋白质的等电点(pI)差异将蛋白质分离。第二向步骤为十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),即利用蛋白质的分子量(Mr, 相对分子量)差异将蛋白质分离。双向凝胶电泳结果中的每个斑点都对应着样本中的一种蛋白。因此,可将上千种不同的蛋白质分离开来,并得到每种蛋白质的等电点、表观分子量和含量等信息。差异蛋白质组学是在双向电泳后用考马斯亮蓝、银离子或荧光染料等将蛋白斑点染色,然后比较差异。仪方生物在各类微生物、培养细胞、动植物组织(如动物软硬组织、体液、植物种子、叶子等)、亚细胞组分的双向电泳分离及后续质谱鉴定中均有丰富的经验。
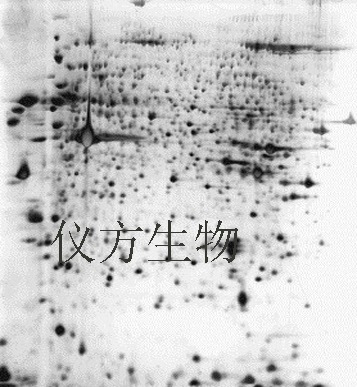
服务项目和主要步骤:
- 根据客户需求定制蛋白质组学实验方案。
- 样品制备(蛋白提取):主要包括植物、动物细胞或组织等的破碎、离心以及定量。
- 第一向IEF等电聚焦实验。
- 第二向SDS-PAGE实验。
- 硝酸银染色或考马斯亮蓝染色。
- 图像分析及数据处理。
- 提供双向电泳的正式实验报告。
- 选取感兴趣的蛋白点进行酶解。
- 对酶解后蛋白进行质谱技术分析(Maldi-Tof-Tof/MS)。
- 提供质谱的正式实验报告。
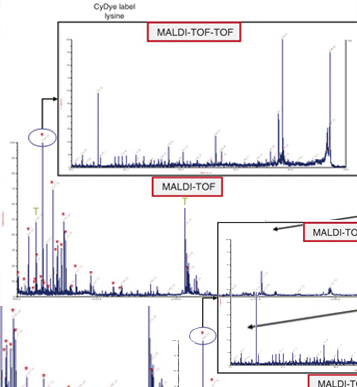
结果报告:
- 实验的试剂耗材、仪器设备、操作过程一份;
- 实验结果凝胶扫描图片;
- 电泳凝胶(可收费干胶);
- 剩余样本。

样品要求:
- 建议客户提供的原样(组织、细胞、菌体等)湿重不少于100mg,如直接提供蛋白提取物,则浓度不少于4ug/ul,总量不少于5mg。
- 样品需为可溶的固体蛋白或液体蛋白溶液,建议液体蛋白溶解体系为6M尿素,2M硫脲,/4%CHAPS/40mM Tris/65mM DTT。如溶解于其它缓冲液体系中,请应提供缓冲液成分。
- 单次硝酸银染色提供蛋白量不小于0.6mg;单次考马斯亮蓝染色提供蛋白量不小于2mg;总蛋白量不小于2mg。
- 用于一次制备型样品,动物组织或菌体的新鲜样本始终不小于1g;收集细胞数量不小于2×108;植物或真菌样品湿重不小于5g;
- 为避免蛋白样品降解,客户所寄的蛋白样本最好为冻干品,若为溶液蛋白,则需低温保存,血液血浆样品应贮于4℃保存,其它液体蛋白溶液贮于-20℃保存。
- 如样品中含有杂质例如核酸、脂类、多糖、色素类等或需其它特殊要求例如浓缩、透析等请提前告知,价格将视进一步处理的难度和耗材用量另行商定。
|